Klasa VII H
28.05.2021
Temat: Powtórzenie wiadomości
Ćw 1,2,3 str 113 ćwiczenia
Ćw 6,7 str 115 ćwiczenia
Wykonaj test z podręcznika str 199
odpowiedzi zapisz w zeszycie (do zadania 7,8 i 9 - napisz obliczenia i odpowiedź)
zeszyty z testem sprawdzę na najbliższej lekcji
19.05.2021 21.05.2021
Temat: Powtórzenie i utrwalenie wiadomości z działu woda i roztwory wodne
12.05.2021, 14.05.2021
Temat: Zanieczyszczenia wody i jej ochrona.
po zajęciach uczeń:
- tłumaczy, w jaki sposób można poznać, że woda jest zanieczyszczona;
- podaje źródła zanieczyszczeń wód;
- omawia zagrożenia środowiska spowodowane skażeniem wód;
- omawia sposoby zapobiegania zanieczyszczeniom wód;
- wyjaśnia, jak działa oczyszczalnia ścieków;
- tłumaczy, w jaki sposób uzdatnia się wodę.
ćwiczenia str 110- 112
praca domowa
zad 1 i 3 str 194
05.05.2021 i 07.05.2021
Temat: Rozcieńczanie i zatężanie roztworu
https://epodreczniki.pl/a/zmiana-stezenia-roztworu/D1A3ZPREe
- rozcieńczanie roztworu
przykład 1 str 184, przykład 2 str 185
- zatężanie roztworu
przykład str 185 -186
Zad 1. Do 450 g roztworu cukru o stężeniu 10% dodano 10 g cukru. Oblicz stężenie procentowe powstałego roztworu. Przedstaw wynik po zaokrągleniu do liczby całkowitej.
Zad 2. Z 740 g roztworu o stężeniu 1% odparowano 220 g wody. Oblicz stężenie procentowe powstałego roztworu. Wynik przedstaw z dokładnością do drugiego miejsca po przecinku.
zad 3. Zmieszano ze sobą dwa roztwory cukru: 50 g o stężeniu 5% i 40 g o stężeniu 12%. Oblicz, jakie stężenie będzie miał otrzymany roztwór. Wynik podaj z dokładnością do jednego miejsca po przecinku.
Praca domowa
Przeprowadź krystalizację soli kuchennej ( cukru lub kwasku cytrynowego).
Do połowy objętości szklanki nalej gorącej wody następnie wsypuj porcjami sól kuchenną, stale mieszając łyżeczką. Dosypywanie soli zakończ wtedy, gdy mimo mieszania kolejna porcja przestanie się rozpuszczać. Na szklance umieść patyczek z nitką tak aby nitka była zanurzona głęboko w roztworze. Codziennie sprawdzaj zachodzące zmiany. Zapisz obserwacje.
Im dłużej będzie przebiegał proces parowania i krystalizacji, tym większe będą kryształy soli. Rozważnie zatem dobierz miejsce, w którym będzie stała hodowla, nie musi być szczególnie jasne (dostęp światła nie wpływa na przebieg krystalizacji, ułatwia za to obserwację), ani zbyt ciepłe (wtedy krystalizacja przebiega szybko, a kryształy są małe).
W czasie wykonywania doświadczenia sporządź notatkę wg poniższego wzoru:
Cel doświadczenia: ........
Data rozpoczęcia i zakończenia doświadczenia (czas trwania obserwacji): .........
Opis przebiegu doświadczenia (tu opiszesz co i jak zrobiłeś i co uzyskałeś): ......
Wnioski: (tu wpisz, czego dowiedziałeś się wykonując to doświadczenie, oraz jakie czynniki wpływają na proces krystalizacji ): ......
Zachowaj kryształy oraz notatkę i przynieś do szkoły do 21 maja
30.04.2021
Temat: Stężenie procentowe roztworu - rozwiązywanie zadań z gęstością
Przepisz przykład 1 i 2 str 183 do zeszytu
Warto obejrzeć film - przypomnienie z ostatniej lekcji
przypomnienie wzorów na gęstość i stężenie %
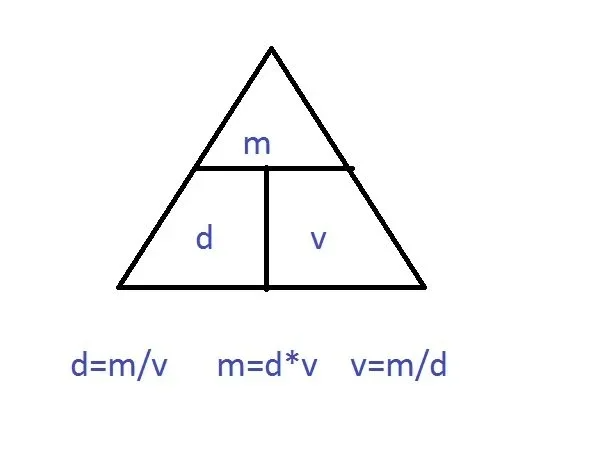
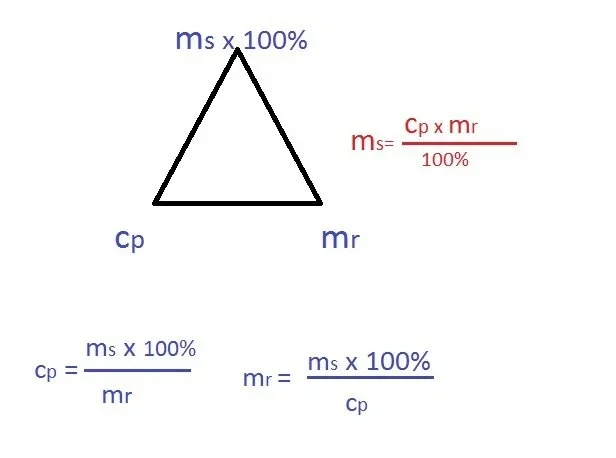
Spróbuj samodzielnie rozwiązać zadania - nie wysyłaj zdjęć
Zad 1. Oblicz ile gramów wodorotlenku sodu potrzeba do przygotowania 0,5 dm3 10-procentowego roztworu o gęstości 1,115 g/cm3
Zad 2. Spirytus salicylowy jest alkoholowym roztworem kwasu salicylowego. Oblicz ile gramów kwasu salicylowego zawiera 250 cm3 spirytusu salicylowego o gęstości 0,8 g/cm3 i stężeniu 2%.
zad 3. Oblicz stężenie procentowe roztworu otrzymanego po rozpuszczeniu 44 g pewnej substancji w 200 cm3 alkoholu etylowego Gęstość alkoholu= 0,78 g/cm3
Praca domowa
Ćw 3 str 106
ćw 4 str 107 ( nie wysyłaj zdjęć)
23.04.2021, 28.04.2021
Temat: Stężenie procentowe roztworu.
Z dzisiejszej lekcji dowiesz się:
- które roztwory są rozcieńczone, a które – stężone
- jak określa się stężenie roztworu
- jak oblicza się stężenie procentowe roztworu
Zadania zadania procenty.docx


Przykład 2
Obliczmy, ile gramów kwasu borowego należy rozpuścić w wodzie, aby otrzymać 150g roztworu o stężeniu 3%.
Przykład 3
Obliczmy, ile kilogramów zalewy do kiszenia ogórków, będącej 3-procentowym roztworem, można przygotować z 0,5 kg soli kamiennej
Praca domowa
Zad 1 w zeszycie
Oblicz stężenie procentowe roztworu otrzymanego w wyniku rozpuszczenia 15 g soli w 60 g wody.
Zadęcie zeszytu wyślij do poniedziałku 26 kwietnia.
21.04.2021
Temat: Czynniki wpływające na rozpuszczanie w wodzie.
praca na lekcji
https://docs.google.com/document/d/1eI4PIp1mqCWsnwy612_nMSizxN7te_rETMH0IFuUxDk/edit?usp=sharing
Praca domowa
ćw 4 i 5 str 104 wszyscy
ćw 6 str 105 chętni
zdjęcia wysłać do piątku godz 15:00
16.04.2021
Temat: Czynniki wpływające na rozpuszczanie w wodzie
- Przeczytaj temat str 174-179
- obejrzyj prezentacje
5.3 czyniki wpływające na rozpuszczalność w wodzie.pptx
warto obejrzeć filmy
- interaktywne krzywe rozpuszczalności
- zapisz w zeszycie
Rozpuszczanie się substancji można przyspieszyć przez :
- mieszanie
- ogrzewanie
- rozdrobnienie
Wyjaśnij pojęcia : roztwór nasycony, roztwór nienasycony, rozpuszczalność.
- Praca domowa
ćw 1,2,3 str 103 nie wysyłaj
14.04.2021
Temat: Woda jako rozpuszczalnik
Prezentacja z lekcji Woda jako rozpuszczalnik.pptx
Zapisz w zeszycie
Roztwór to mieszanina co najmniej dwóch składników - substancji rozpuszczonej i rozpuszczalnika.
Roztwór właściwy – roztwór, w którym cząstki substancji rozpuszczonej mają rozmiary mniejsze od 1 nm (10−9 m) czyli substancja rozpuszczona jest rozdrobniona do pojedynczych drobin ( atomów cząsteczek lub jonów ) np.: cukier z wodą sól z wodą
1 nm ( 1 nanometr)- to milionowa część milimetra = 10−9 metra
Koloid - roztwór, w którym substancja rozpuszczona tworzy duże cząstki od 1 nm do 100 nm ( od 10−9 m do 10−7 m) np.: białko jaja w wodzie, roztwór żelatyny, mleko.
Zawiesina - średnica cząstek substancji rozpuszczonej jest większa od 100 nm (10−7 m) np.: mąka z wodą, kreda z wodą, leki w postaci zawiesiny.
Praca domowa
zad 2 i 3 str 173
oraz wykonaj doświadczenie str 173
zdjęcia zeszytu j i doświadczenia wyślij do 16 kwietnia.
09.04.2021
Temat: Budowa cząsteczki wody
Przepisz do zeszytu
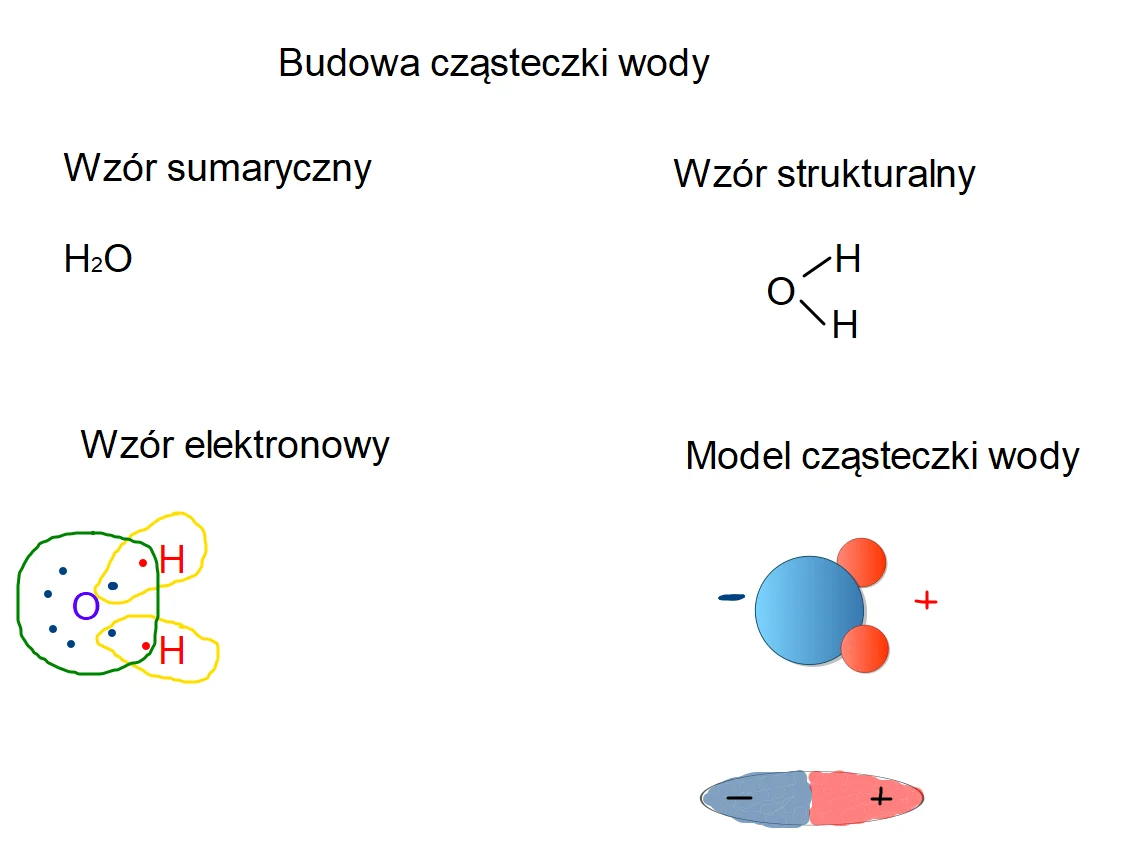
Odpowiedz na pytania
1. Jakie wiązania występują w cząsteczce wody?
2. Co to jest dipol?
3. Co to jest wiązanie wodorowe?
07.04.2021
Temat: Właściwości wody i jej rola w przyrodzie.
- przeczytaj temat strony 163- 169
- obejrzyj prezentacje 5.1 Właściwości wody.pptx
- uzupełnij ćwiczenia
str 98, 99, 100
- praca domowa
zad 2 i 3 str 167
31.03.2021
Temat: Omówienie i poprawa sprawdzianu
pierwiastki chemiczne
wzory sumaryczne i strukturalne
równania reakcji chemicznych
Kolorowanka świąteczna- wzory i nazwy związków chemicznych
26.03.2021
Temat: Sprawdzian wiadomości z działu"Gazy i ich mieszaniny"
link do testu https://www.testportal.pl/test.html?t=nbwVatPySCU5
Test dostępny od 13:35- 14:20 czas na napisanie 30 min.
Przystąpienie do sprawdzianu jest obowiązkowe. Osoby które nie napiszą testu w wyznaczonym terminie otrzymują ocenę niedostateczną.
24.03.2021
Temat: Powtórzenie i utrwalenie wiadomości z działu " Gazy i ich mieszaniny"
Praca na lekcji
https://wordwall.net/play/13278/565/620
19.03.2021
Temat: Powtórzenie wiadomości z działu” Gazy i ich mieszaniny”.
Przypomnij sobie
- Co to jest powietrze i jaki jest jego skład?
- Jak można otrzymać tlen i jakie są jego właściwości
- Obieg tlenu i dwutlenku węgla w przyrodzie
- Tlenki metali i niemetali
- W jaki sposób można otrzymać tlenki
- Właściwości i zastosowanie tlenków
- Azot i gazy szlachetne- właściwości i zastosowanie
- Jak zidentyfikować dwutlenek węgla, tlen i wodór (reakcje charakterystyczne)
- Otrzymywanie właściwości i zastosowanie tlenku węgla IV
- Otrzymywanie i właściwości wodoru
Rozwiąż test z podręcznika str 160 odpowiedzi zapisz w zeszycie nie wysyłaj sprawdzimy na kolejnej lekcji
17.03.2021
Temat: Zanieczyszczenia powietrza i jego ochrona
Prezentacja z lekcji Zanieczyszczenia powietrza i jego ochrona.pptx
ćw 4,5,6 str 90
Praca domowa
ćw 1 str 88
ćw 2,3 str 89 nie wysyłaj
Praca dla chętnych
Zrób plakat na temat "Zanieczyszczenia powietrza i jego ochrona" technika dowolna, praca na dużej kartce A3 - Zdjęcie wyślij do 31 marca na e-meila, prace zachowaj i przynieś do szkoły.
12.03.2021
Temat: Wodór gaz o najmniejszej gęstości
Przeczytaj temat str 145 - 148
obejrzyj film https://youtu.be/A_0ahh_NxSM
- w zeszycie zapisz właściwości wodoru
- uzupełnij ćwiczenie 2i 3 str 85, ćw 4,5 str 86
- zapisz reakcje otrzymywania wodorku sodu, wodorku wapnia, chlorowodoru oraz siarkowodoru
- wypisz zastosowania wodoru
Praca domowa
Ćw 1 str 84 (wyślij do 15 marca) ćwiczenia wysłane po terminie nie będą sprawdzane
Praca dodatkowa z chemii Napisz artykuł do gazetki szkolnej.docx
10.03.2021
Temat: Dwutlenek węgla- zmienny składnik powietrza.
- otrzymywanie tlenku węgla(IV) i badanie jego właściwości
- zastosowanie tlenku węgla(IV)
- rozwiązywanie ćwiczeń str 81-83
- Praca domowa
- zad 1 str 144 nie wysyłaj
05.03.2021
Temat: Azot i gazy szlachetne
Przeczytaj temat str 137-140
- W zeszycie wypisz właściwości azotu
- przyjrzyj się rysunkowi 4,8 str 138 i uzupełnij ćwiczenie 2 str 79
- wypisz zastosowania azotu
- uzupełnij ćwiczenie 4,5 i 6 str 80
- Zastanów się jakie właściwości i zastosowania mają helowce (gazy szlachetne)
Praca domowa
Zad 1i 2 str 139 ( nie wysyłaj)
https://learningapps.org/view1390785
03.03.2021
Temat: Tlenki metali i niemetali
Praca na lekcji
Zad. 1.Napisz wzory sumaryczne związków o nazwach;
tlenek miedzi(I)
tlenek żelaza(II)
tlenek chromu(III)
tlenek manganu(IV)
tlenek wanadu(V)
Zad.2. Narysuj wzory strukturalne związków o nazwach:
tlenek węgla(IV)
tlenek azotu(III)
tlenek siarki(VI)
tlenek azotu(V)
tlenek selenu(IV)
Zad.3. Napisz równania reakcji spalania w tlenie następujących substancji:
magnezu, węgla, glinu, siarki i fosforu.
Zad.4. Uporządkuj tlenki według ich wzrastającej masy cząsteczkowej:
tlenek srebra(I)
tlenek azotu(II)
tlenek wapnia
tlenek siarki(VI)
tlenek sodu
Zad 5 * Tlenek ołowiu(II) bardzo łatwo ulega redukcji po ogrzaniu ze sproszkowanym węglem. Oblicz, ile tlenku ołowiu(II) należy użyć do reakcji, aby otrzymać 2 g ołowiu.
(Wynik zaokrąglij do części setnych, Napisz odpowiednie równanie reakcji)
Praca domowa
Uzupełnij kartę pracy Tlenki kl 7.docx Pracę wyślij do 8 marca na meila , prace wysłane po terminie nie będą oceniane.
lub Tlenki kl 7.pdf
25.02.2021
Temat: Tlenki metali i niemetali
- Obejrzyj doświadczenie 4.5 w podręczniku str 113
- Przepisz równania reakcji do zeszytu (podpisz nazwy substratów i produktów)
2 Mg + O₂➝ 2 MgO
C + O₂➝ CO₂
S + O₂➝ SO₂ - Tlenki dzielimy na tlenki metali i niemetali - napisz po trzy przykłady tych tlenków
- Zastanów się czym się różni spalanie od utleniania
- Reakcja egzoenergetyczna - reakcja raz zapoczątkowana przebiega dalej samoistnie, energia wydzielana jest na zewnątrz w postaci ciepła lub światła.np.: spalanie węgla lub drzewa
- C + O₂➝ CO₂
- Reakcja endoenergetyczna - wymaga dostarczenia energii np.: pieczenie ciasta, smażenie mięsa.
- 2 HgO ➝ 2 Hg + O₂
- Zastanów się jakie właściwości i zastosowania mają tlenki metali i niemetali
- cw 5 str 78
praca domowa - Cw 2,3,4 str 77 (nie wysyłaj)
24.02.2021
Temat: Tlen- niezbędny do życia składnik powietrza
https://player.slideplayer.pl/37/10699158/#
Praca domowa
ćw 5 i 6 str 75
chętni ćw 1 i 2 str 73
19.02.2021
Temat: Powietrze i jego składniki
Przeczytaj temat str 125-128
Obejrzyj film: https://e-zasoby.wsip.pl/E81077/E81077_film_10.mp4
oraz
W zeszycie wypisz składniki powietrza oraz ich zawartość % objętościowy.
Zad 1. Oblicz objętości azotu i tlenu znajdujących się w powietrzu w twoim pokoju.
Wskazówka: Najpierw oblicz objętość pomieszczenia (zmierz długość, szerokość i wysokość pokoju).
ćwiczenia str 70 i 71 (nie wysyłaj zdjęć)
17.02.2021
Temat: Sprawdzian wiadomości z działu łączenie się atomów
link do sprawdzianu
https://www.testportal.pl/test.html?t=DNZUrxXfP6pp
10.02.2021, 12.02.2021
Temat: Powtórzenie i utrwalenie wiadomości z działu łączenie się atomów
Ważne pojęcia
- 3.1. Dublet i oktet elektronowy, jon, anion, kation, wiązanie jonowe
- 3.2. Wspólna para elektronowa, wiązanie atomowe (kowalencyjne), wiązanie atomowe (kowalencyjne) spolaryzowane, dipol elektryczny, elektroujemność
- 3.3. Wartościowość, wzór strukturalny, wzór sumaryczny
- 3.4. Masa cząsteczkowa
- 3.5. Równanie reakcji, współczynniki stechiometryczne, reakcja łączenia (syntezy), reakcja rozkładu (analizy), reakcja wymiany
- 3.6. Prawo zachowania masy, prawo stałości składu, stosunek masowy pierwiastków
Rozwiązywanie testu z podręcznika
Rozwiązywanie zadań powtórzeniowych z zeszytu ćwiczeń
Praca domowa
Zad 3 i 6 str 121 (nie wysyłaj)
Przygotuj się do sprawdzianu
https://learningapps.org/watch?v=ph8z6wcet21
https://learningapps.org/watch?v=psx6j6u6a21
Obejrzyj film
05.02.2021
Temat: Prawa rządzące reakcjami chemicznymi
Zad 1
W wyniku spalenia 12,7 g miedzi w tlenie otrzymano 15,9 g tlenku miedzi(II) CuO. Oblicz, ile gramów tlenu wzięło udział w tej reakcji chemicznej. Zapisz odpowiednie równanie reakcji chemicznej oraz obliczenia.
Zad 2
Oblicz stosunek masowy żelaza do siarki w siarczku żelaza(III) Fe2S3.
Praca domowa
Zad 3 str 116
Chętni wykonaj ćwiczenie str 116 z podręcznika. Możesz pracować sam lub w grupie 2-3 osobowej. Przygotuj prezentacje w której umieścisz zdjęcia, obserwacje i wnioski z przeprowadzonego doświadczenia. Prace zaprezentuj podczas lekcji powtórzeniowej w środę 10 lutego.
Przygotuj się do powtórzenia z działu 3
03.02.2020
Temat: Prawa rządzące reakcjami chemicznymi
Prawo zachowania masy
Łączna masa substratów reakcji jest równa łącznej masie produktów.
Prawo stałości składu (prawo stosunków stałych)
Stosunek masowy pierwiastków w związku chemicznym jest wielkością stałą i charakterystyczną dla danego związku
Przykłady zadań
Prawo zachowania masy

Prawo stałości składu

Praca domowa
ćw 3 i 4 str 63 (sprawdzimy na kolejnej lekcji)
29.01.2020
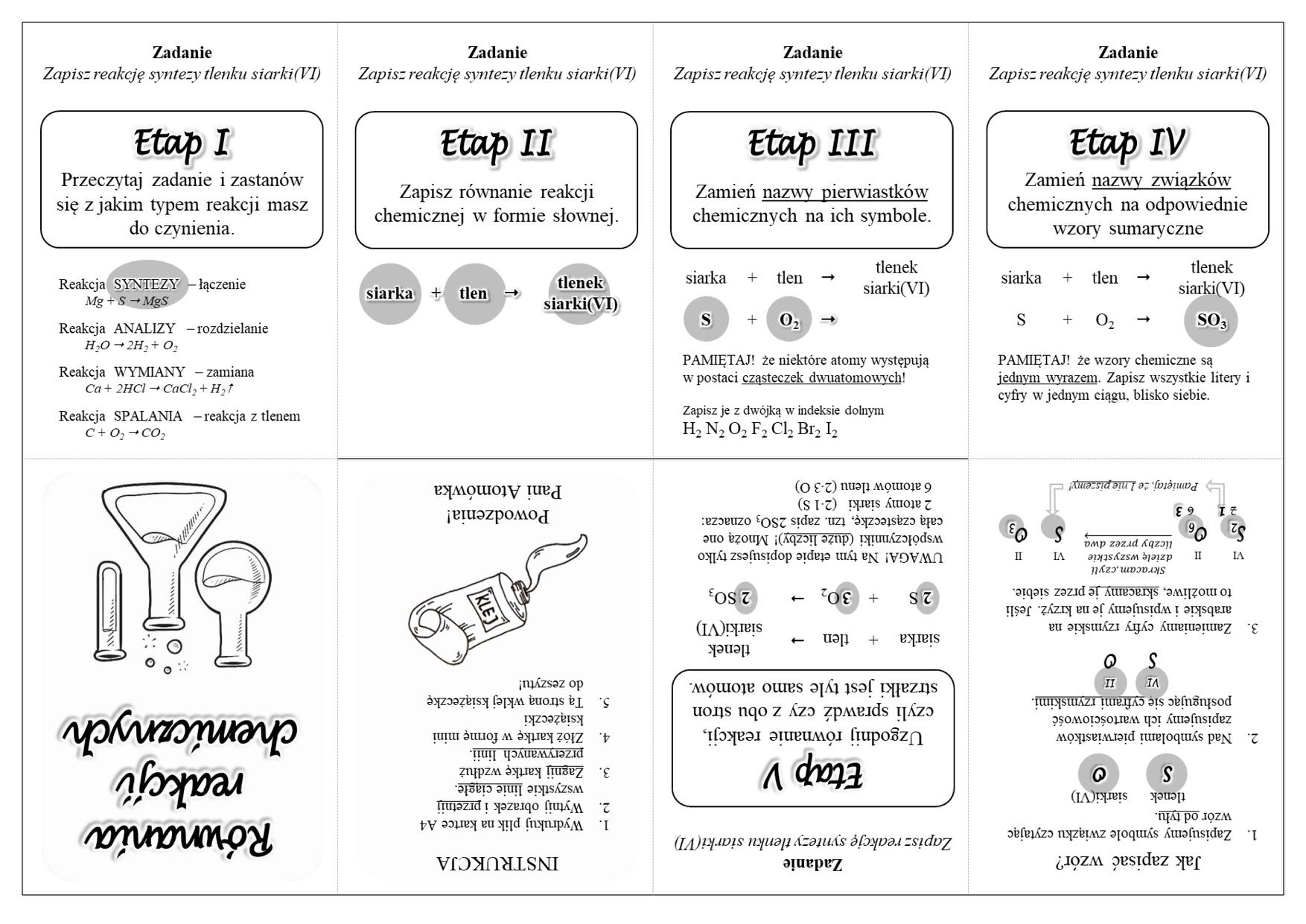
Temat: Typy reakcji chemicznych
Zad 1. Ułóż równania reakcji przedstawione schematem.
- wapń + tlen --> tlenek wapnia
- siarka + glin --> siarczek glinu
- tlenek miedzi(II) + wodór --> tlenek wodoru + miedź
Zad 2. Uzgodnij równania reakcji chemicznych
- ….N2O5 --> ….N2 +…O2
- ….CH4 + …O2 --> ….CO2 + …H2O
- ….AuCl --> …Au + …Cl2

 równania reakcji chemicznych.jpg
równania reakcji chemicznych.jpg
Praca domowa
ćw 3,4,5 str 61
27.01.2020
Temat: Typy reakcji chemicznych
Przeczytaj temat str 105 - 110
Praca domowa
uzupełnij kartę pracy
lub Karta pracy typy reakcji.pdf
( to jest to samo tylko w innym formacie)
wyślij na meila do poniedziałku 1 lutego
22.01.2020
Temat: Typy reakcji chemicznych
obejrzyj film
W zeszycie wyjaśnij pojęcia
reakcja syntezy, reakcja analizy, reakcja wymiany
Praca domowa
cw1,2 str 60
Wyślij zdjęcie do poniedziałku
20.01.2020
Temat: Masa cząsteczkowa pierwiastka i związku chemicznego
Praca na lekcji
Zad 1. Ustal wzór sumaryczny tlenku węgla(IV) - przypomnienie z ostatniej lekcji
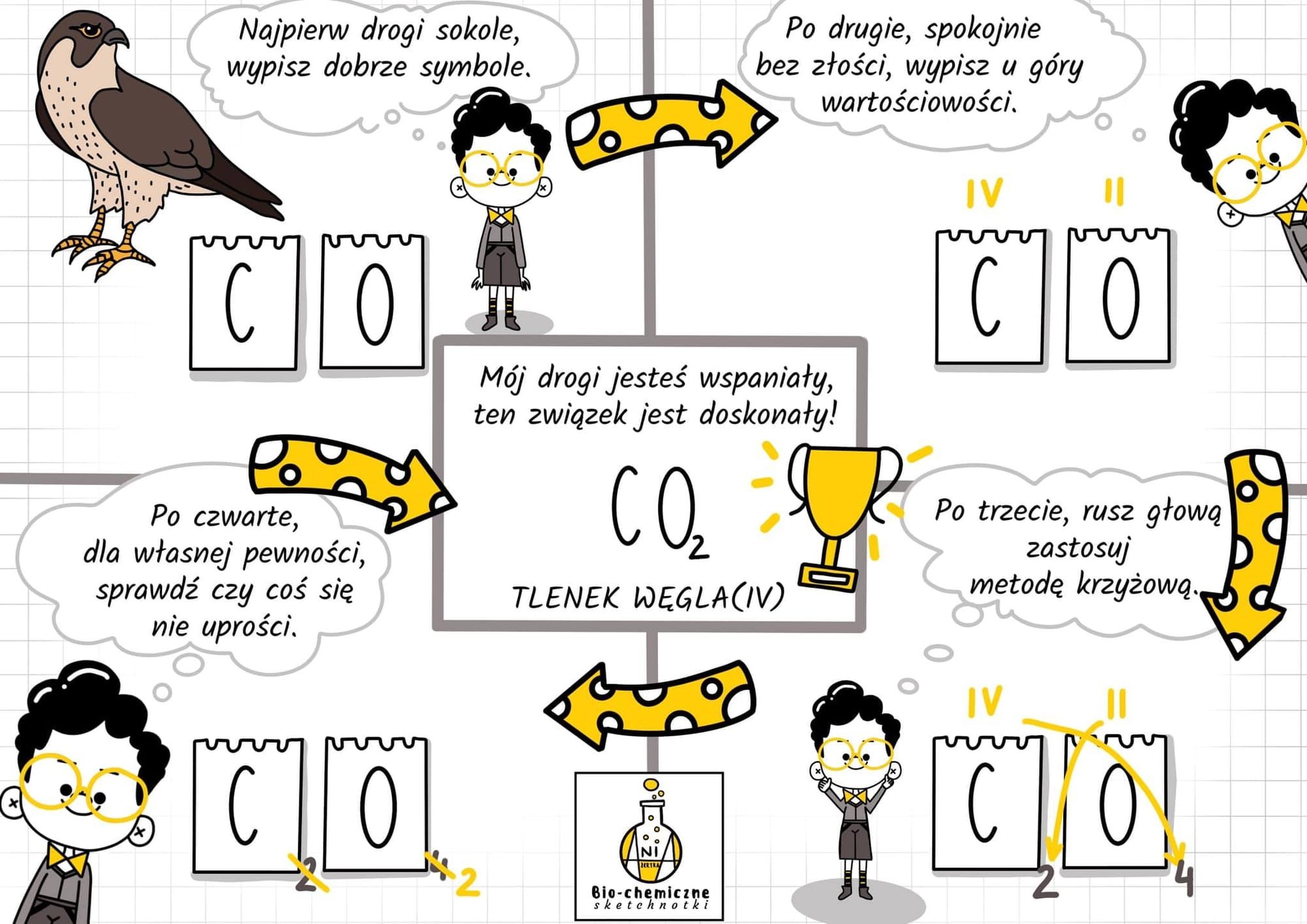
Zad 2. Zapisz masy atomowe pierwiastków chemicznych przedstawionych za pomocą modeli. Skorzystaj z układu okresowego pierwiastków chemicznych. Pamiętaj o zaokrągleniu do jedności. Wyjątek stanowi chlor mCl = 35,5 u




mH = 1 u
mO = 16 u
mN = ______u
mS = ______ u
|
|
|
|
mH = 1 u | mO = 16 u | mN = ______u | mS = ______ u |
obejrzyj film
Zad 3. Oblicz masę cząsteczkową pierwiastka (zobacz przykład 1 i 2 w podręczniku str 102)
a) wodoru
mH2 =
b) azotu
mN2 =
Zad 4. Oblicz masę cząsteczkową związku chemicznego (zobacz przykłady 3-5 str 103)
a) tlenku siarki(IV)
b) kwasu siarkowego(VI)
Praca domowa
Uzupełnij karę pracy
karta-pracy-6-masa-atomowa-masa-czasteczkowa.doc
pracę wyślij do 21stycznia na chemiawisznice@gmail.com
16.12.2020 i 18.12. 2020
Temat: Wzory sumaryczne i strukturalne związków chemicznych
Podręcznik strona 97
Notatka z lekcji Wartościowość pierwiastka 2.doc
Tabela maksymalna wartościowość 2020-12-15 (3).png
wykonaj ćwiczenia str 56 i 57
Praca domowa
Zad 1,2,3 str 101 ( w zadaniu pierwszym spróbuj napisać również wzory strukturalne)
Praca dla chętnych
Wykonaj ćwiczenie str 101 wyślij zdjęcie pracy do 21.12.2020
Plansze zachowaj i przynieś do szkoły.
11.12.2020
Temat: Wiązanie kowalencyjne spolaryzowane
przeczytaj z e-podręcznika
https://epodreczniki.pl/a/wiazania-chemiczne---kowalencyjne-i-kowalencyjne-spolaryzowane/DZZ44URWd
( jeśli masz problem z otworzeniem linku - skopiuj go i wklej w przeglądarkę,
lub wpisz w swojej przeglądarce - e podręczniki wiązanie kowalencyjne)
wykonaj zadania z e-podręcznika
Praca domowa
zad 3 str 96
09.12.2020
Temat: Wiązanie kowalencyjne
podręcznik str 91-96
Zapisz do zeszytu: Wiązanie kowalencyjne.doc
https://learningapps.org/view9562988
Praca domowa
Zad 1. Jakie wiązanie występuje w cząsteczce wodoru, a jakie w cząsteczce wody?
Narysuj odpowiednie wzory elektronowe i kreskowe.
ćwiczenie 1 i 2 str 54
04.12.2020
Temat: Łączenie się pierwiastków w związki chemiczne
Przeczytaj temat str. 85-90
Odpowiedz ustnie na pytania
Co to jest dublet i oktet elektronowy?
Jaki ładunek mają kationy, a jaki aniony?
Kiedy dochodzi do utworzenia wiązania jonowego?
Jakie właściwości mają związki jonowe?
Przeanalizuj rysunki na str 86
Praca domowa
Uzupełnij ćwiczenia str 52 i 53
2.12.2020
Temat: Sprawdzian wiadomości z działu budowa atomu a układ okresowy pierwiastków chemicznych
link do testu https://www.testportal.pl/test.html?t=G65wPtqRNB2x
aktywny w czasie trwania lekcji 8:00 - 8:45
przygotuj układ okresowy pierwiastków chemicznych
Sprawdzian wiadomości z działu drugiego - 2 grudnia
25.11.2020 i 27.11.2020
Temat: Powtórzenie i utrwalenie wiadomości z działu budowa atomu
Praca samodzielna: zrób test do działu str 81,82 - Podręcznik- odpowiedzi wyślij na meila do 1 grudnia .
Praca na lekcji rozwiązywanie zadań w zeszycie ćwiczeń str 46-50.
20.11.2020
Temat: Położenie pierwiastka w układzie okresowym
Przeczytaj temat z podręcznika strona 73-76
możesz również obejrzeć film
zapisz do zeszytu
Położenie pierwiastka w układzie okresowym jest ściśle związane z budową jego atomów.
Numer okresu jest równy liczbie powłok elektronowych.
Numer grupy jest informacją o liczbie elektronów walencyjnych.
Jeżeli numer grupy jest większy od dziesięciu, to liczbę elektronów obliczamy odejmując od numeru grupy 10.
Zadanie
Na podstawie położenia tlenu w układzie okresowym odpowiedz na poniższe pytania.
- Jaki symbol ma tlen?
- Ile protonów znajduje się w jądrze atomowym tlenu?
- Ile elektronów znajduje się w atomie tlenu?
- Ile elektronów walencyjnych znajduje się w atomie tlenu?
wykonaj ćwiczenia str 44 i 45
Praca domowa
zad 2 i 3 str 76 (nie musisz wysyłać omówimy na kolejnej lekcji)
Temat: Masa atomowa pierwiastka - izotopy
Przeczytaj temat z podręcznika strona 69-72
Odpowiedz ustnie na pytania:
1) Dlaczego masa atomowa pierwiastka ma wartość ułamkową
2) Co to są izotopy i jakie są ich rodzaje?
3) Jakie zastosowanie mają izotopy promieniotwórcze
pisemnie
Izotopy- to atomy tego samego pierwiastka różniące się liczbą neutronów w jądrze atomowym
1) narysuj modele izotopów wodoru
2) Wyznacz masę atomową występującego w przyrodzie chloru, będącego mieszaniną dwóch izotopów ₁₇³⁵Cl(75,77%) i ₁₇³⁷Cl (24,23%) - przykład str 70
obejrzyj film o masie atomowej
obejrzyj film o zastosowaniu izotopów
Wykonaj ćwiczenia str 41-43
Praca domowa
Zad 1, 2 str 72 Podręcznik
Zadanie dla chętnych
Srebro ma dwa trwałe izotopy. W srebrze występującym w przyrodzie znajduje się 51,82% izotopu o liczbie masowej 107, natomiast izotopu o liczbie masowej 109 jest 48,18% . Oblicz średnią masę atomową srebra.
oraz ćw 1 str 41, ćw 3 str 42
13 listopad kartkówka budowa atomu i układ okresowy pierwiastków
https://www.testportal.pl/test.html?t=7VwyHV5smSiH
test aktywny od 14
05.11.2020 i 13.11.2020
Temat: Układ okresowy pierwiastków chemicznych
gra edukacyjna pierwiastki
https://wordwall.net/pl/resource/5497187
Zapisać do zeszytu i zapamiętać
Prawo okresowości:
Właściwości fizyczne i chemiczne pierwiastków uporządkowanych według wzrastającej liczby atomowej powtarzają się w sposób okresowy
Układ okresowy składa się z pionowych kolumn zwanych grupami i poziomych rzędów zwanych okresami.
Wyróżniamy 18 grup i 7 okresów.
Aktywność chemiczna metali z 1. i 2. grupy rośnie w obrębie grupy wraz ze wzrostem numeru okresu.
Aktywność chemiczna niemetali zmniejsza się w obrębie grupy wraz ze wzrostem numeru okresu.
W okresach wraz ze wzrostem numeru grupy aktywność chemiczna metali maleje,
natomiast aktywność chemiczna niemetali rośnie.
ćw 6 str 40
Obejrzyj prezentacje
Układ okresowy pierwiastków chemicznych.pptx
Praca domowa
Zadanie 1 i 2 str. 68 Podręcznik
ćwiczenia str 38, 39
Nie wysyłaj na emaila - omówimy na kolejnej lekcji
04.11.2020
Temat: Budowa atomu
ćwiczenia strona 36 i 37
30,10,2020
Temat: Budowa atomu
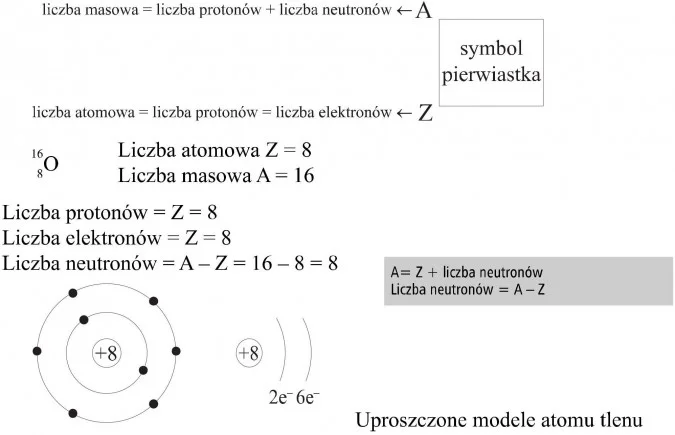
Konfiguracja elektronowa atomu tlenu [2,6]
Podręcznik przykład str 59
Elektrony poruszają się w różnych odległościach od jądra atomowego. Przestrzenie w których prawdopodobieństwo znalezienia elektronu jest największe nazywamy powłokami elektronowymi. Powłok tych może być maksymalnie 7.
Zwykle oznacza się je literami K,L,M,N,O,P,Q
Podręcznik tabelka str 59
Elektrony walencyjne- elektrony na zewnętrznej powłoce ( najbardziej oddalone od jądra). decydują o właściwościach chemicznych pierwiastka.
Praca domowa
ćw 1 str 36 (Nie wysyłaj zdjęć omówimy na lekcji )
przykład 3 i 4 (beryl i neon)
28.10.2020
Temat: Budowa atomu.
Przeczytaj temat str 57,58
Odpowiedz na pytania
1. Co to jest atom?
2. Z jakich cząstek składa się atom?
3. Co to jest liczba masowa?
4. Co to jest liczba atomowa (porządkowa)?
W środku atomu znajduje się jądro, w którym są dwa rodzaje cząstek - dodatnio naładowane protony i elektrycznie obojętne neutrony. Wokół jądra poruszają się elektrony o ładunku ujemnym.
Atomy danego pierwiastka mają ściśle określoną liczbę protonów i elektronów.
Liczbę protonów w jądrze atomu nazywamy liczbą atomową i oznaczamy literą Z.
Zbiór atomów o tej samej liczbie Z nazywamy pierwiastkiem chemicznym.
Sumę liczb protonów i neutronów nazywamy liczbą masową i oznaczamy literą A.
